近日,我校藥學院韓峰教授課題組、基礎醫(yī)學院盧應梅教授課題組以及蔣建東院士團隊合作在《細胞死亡和分化》(Cell Death & Differentiation)期刊在線發(fā)表了題為《內(nèi)皮細胞源性SEMA3G通過誘導c-Myc降解抑制膠質(zhì)母細胞瘤干細胞》(Endothelial cells-derived SEMA3G suppresses glioblastoma stem cells by inducing c-Myc degradation)的研究論文,闡明了內(nèi)皮細胞來源的SEMA3G通過誘導關鍵標志物c-Myc的降解,進而破壞GSCs干性維持內(nèi)在驅(qū)動力的分子機制。這一研究揭示了SEMA3G-c-Myc軸對膠質(zhì)母細胞瘤微環(huán)境中細胞間通訊的擾動作用,為膠質(zhì)瘤的靶標發(fā)現(xiàn)提供了新的研究思路。

膠質(zhì)母細胞瘤特征性的異常血管新生不僅為腫瘤提供營養(yǎng)和氧氣支持,更構(gòu)成了獨特的腫瘤微環(huán)境。膠質(zhì)母細胞瘤干細胞(Glioblastoma stem cells,GSCs)傾向于定位于血管周圍微環(huán)境,通過與內(nèi)皮細胞的復雜雙向互作維持其干性特征。深入探究血管內(nèi)皮細胞與GSCs間細胞通訊的關鍵分子及其調(diào)控網(wǎng)絡,將為膠質(zhì)母細胞瘤的新靶標發(fā)現(xiàn)提供重要的理論依據(jù)和新策略。
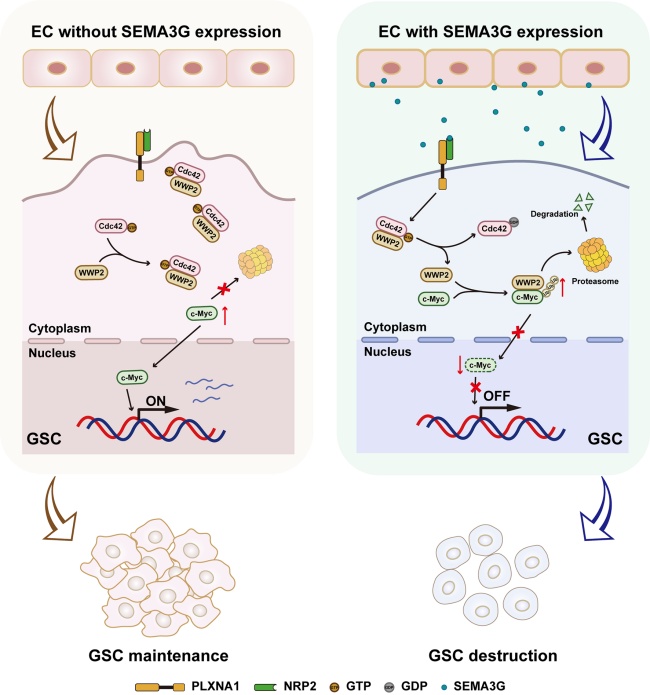
本研究從腦血管內(nèi)皮細胞視角出發(fā),通過整合分析多組公共數(shù)據(jù)集以及膠質(zhì)母細胞瘤患者樣本,發(fā)現(xiàn)內(nèi)皮細胞特異性表達的SEMA3G可能通過細胞間互作機制參與膠質(zhì)母細胞瘤進展。動物實驗結(jié)果顯示,內(nèi)皮細胞特異性Sema3G缺失促進膠質(zhì)母細胞瘤的生長并縮短荷瘤小鼠的生存期。反之,SEMA3G重組蛋白則抑制腫瘤進展并延長小鼠生存其期。進一步的機制研究表明,SEMA3G通過作用于GSC的NRP2/PLXNA1受體復合物特異性抑制Cdc42-GTP活性。而失活狀態(tài)的Cdc42與E3泛素連接酶WWP2的結(jié)合偏好性減弱,促使WWP2與c-Myc結(jié)合并引起c-Myc的泛素-蛋白酶體途徑降解,導致GSC干性遭到破壞。本研究在國際上首次系統(tǒng)闡明腦血管內(nèi)皮源性SEMA3G通過NRP2/PLXNA1-Cdc42-WWP2-c-Myc級聯(lián)信號軸調(diào)控GSC干性的分子機制,具有重要科學價值,為開發(fā)針對膠質(zhì)母細胞瘤干細胞微環(huán)境的精準治療策略提供了候選新靶點。
我校藥學院韓峰教授、基礎醫(yī)學院盧應梅教授以及中國醫(yī)學科學院蔣建東院士為本論文共同通訊作者。南京醫(yī)科大學常州醫(yī)學中心博士后閔鵬翔、藥學院講師馮黎黎為共同第一作者。本項目在實施過程中得到南京醫(yī)科大學汪秀星教授等專家的支持和幫助。
本研究得到國家重點研發(fā)計劃等項目的資助。
原文鏈接:https://www.nature.com/articles/s41418-025-01534-3
(撰稿/閔鵬翔 馮黎黎;審核/韓峰)

