近日,基礎醫學院藥理學系魯明課題組在《先進科學》(Advanced Science)發表題為《胞外 LCN2 結合 24p3R阻礙帕金森病中星形膠質細胞吞噬α-突觸核蛋白》(Extracellular LCN2 Binding to 24p3R in Astrocytes Impedes α-synuclein Endocytosis in Parkinson’s Disease)的研究論文,首次發現24p3R是星形膠質細胞吞噬α-突觸核蛋白(α-Syn)的新型關鍵受體,揭示 LCN2/24p3R 是調控腦內α-Syn 聚集和傳播的關鍵配體/受體靶標。

病理性α-Syn的聚集和傳播是帕金森病發病的重要驅動因素,受累神經元釋放α-Syn,細胞外 α-Syn啟動病理性α-Syn 在神經元之間的傳播,加速神經元退變壞死。促進細胞外病理性α-Syn清除是帕金森病和相關 α-突觸核蛋白病治療策略的潛在方向。星形膠質細胞是攝取/清除細胞外 α-Syn 的關鍵細胞,發揮重要作用,調控其吞噬α-Syn的潛在機制和關鍵分子尚未發現。研究人員通過蛋白質譜、轉錄組學、表面等離子共振、截短質粒驗證等多種分子生物學技術發現24p3R是星形膠質細胞吞噬α-Syn的關鍵受體,24p3R特異性結合α-Syn介導其內吞,而LCN2競爭性抑制24p3R結合α-Syn,阻礙星形膠質細胞吞噬α-Syn,引起胞外α-Syn的聚集、傳播,進而促進星形膠質細胞生成和釋放LCN2,形成正反饋惡性循環,導致多巴胺能神經元退變。進一步應用多種星形膠質細胞條件敲除小鼠共同證實LCN2/24p3R 是調控腦內α-Syn 聚集和傳播的關鍵配體/受體靶標,為治療帕金森病和相關 α-突觸核蛋白病提供了新策略。
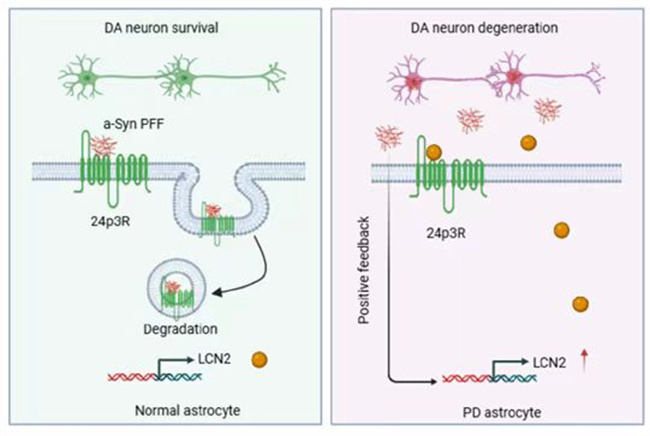
本研究闡明了LCN2/24p3R調控星形膠質細胞吞噬α-Syn的分子機制,為帕金森病和相關α-突觸核蛋白病提供了全新治療靶標。
基礎醫學院藥理學系魯明教授、杜仁紅副教授為該論文的共同通訊作者。基礎醫學院藥理學系研究生焦瑩瑩和田甜為共同第一作者。該項研究得到科技部2030“腦科學與類腦研究”重大項目和國家自然科學基金等資助。
原文鏈接:https://doi.org/10.1002/advs.202501694
(撰稿/魯明課題組;審核/陳峰 王覺進)

